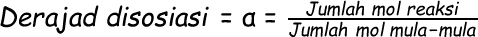Konsep Kesetimbangan Dinamis
Reaksi kesetimbangan adalah reaksi dimana zat-zat hasil reaksi ( produk ) dapat bereaksi kembali membentuk zat-zat semula ( reaktan ). Jadi reaksi berlangsung dua arah ( reversibel ) :
Kapankah suatu reaksi bolak-balik mencapai keadaan setimbang ?
Pada saat laju reaksi ke kanan = laju reaksi ke kiri
Bagaimana kita dapat mengetahui bahwa suatu reaksi bolak-balik telah mencapai kesetimbangan ?
Saat tercapai kesetimbangan jumlah zat-zatnya baik reaktan maupun produk tidak lagi berubah. Jumlah zat sebanding dengan mol dan konsentrasi sehingga saat setimbang mol dan konsentrasi zat-zatnya tetap.
Jelaskan, mengapa kesetimbangan kimia disebut kesetimbangan dinamis !
Jelaskan, mengapa kesetimbangan kimia disebut kesetimbangan dinamis !
Walaupun reaksi kimia sudah mencapai keadaan setimbang akan tetapi reaksi tetap berlangsung pada tingkat molekul/mikroskopis. karena kecepatan reaksi maju/ke kanan = reaksi balik/ke kiri maka seakan-akan reaksinya sudah berhenti.
Ciri khas reaksi kesetimbangan :
"Zat-zat ruas kiri ( reaktannya ) tidak pernah habis"
Pada saat terjadi kesetimbangan, maka harga tetapan kesetimbangan ( Kc ) dapat ditentukan. Nilainya ditentukan dengan menggunakan perbandingan konsentrasi zat-zatnya saat tercapai kesetimbangan.
dari bentuk persamaan di atas dapat disimpulkan :
Jika nikai K > 1 maka hasil/produk yang dihasilkan banyak
Jika nikai K < 1 maka hasil/produk yang dihasilkan sedikit
Hal PENTING yang perlu kalian ketahui !
Untuk reaksi yang sama harga Kc hanya dipengaruhi suhu. Selama suhu tetap maka K tetap. Harga K berubah hanya apabila suhunya berubah. perubahan harga K tergantung jenis reaksinya :
- Reaksi Endoterm ( menyerap kalor / delta H nya positif ) : K berbanding lurus dengan suhu. Artinya jika suhunya meningkat maka K nya juga meningkat dan sebaliknya jika suhunya menurun maka K nya juga menurun.
- Reaksi Eksoterm ( melepas kalor / delta H nya negatif ) : K berbanding terbalik dengan suhu. Artinya jika suhunya meningkat maka K nya menurun dan sebaliknya jika suhunya menurun maka K nya meningkat.
Membandingkan harga K dengan beberapa reaksi :
- Jika reaksi dibalik maka K menjadi 1/K
- Jika reaksinya dikalikan n maka K menjadi Kn
- Jika reaksinya dibagi n maka K menjadi akar n nya K
- Jika dua reaksi atau lebih dijumlahkan maka harga K tiap-tiap reaksi dikalikan
Diketahui tetapan kesetimbangan 2 reaksi sebagai berikut :


Kc nya berturut-turut adalah 4 dan 8 maka tetapan kesetimbangan bagi reaksi :
adalah !
Untuk mengetahui perubahan nilai tetapan kesetimbangan ( K ) yang kita perhatikan adalah senyawa yang spesifik yang ada untuk tiap-tiap reaksi.
untuk reaksi pertama yang kita perhatikan perubahannya adalah senyawa B karena senyawa B tidak ada pada reaksi ke dua. Senyawa B yang mula-mula di ruas kiri menjadi di ruas kanan dan dikalikan 2 (karena angka koefisiennya berubah dari 1 menjadi 2 berarti berubah menjadi dua kalinya).
maka reaksinya ditulis :

karena dibalik maka K = 4 menjadi K = 1/4 kemudian dikalikan 2 maka K = 1/4 berubah lagi menjadi kuadratnya K = (1/4)2 = 1/16
untuk reaksi kedua tidak mengalami perubahan karena senyawa spesifiknya yaitu senyawa D tetap ada di ruas kiri dan angka koefisiennya pun tetap = 1 sehingga K nya juga tetap 8. Dari reaksi pertama yang telah diubah dengan reaksi kedua digabung menjadi :
senyawa yang sama di ruas kiri dan kanan saling coret....
karena digabung maka nilai K = 1/16 dan K = 8 dikalikan sehingga menjadi :
K = 1/16 . 8 = 1/2
Pergeseran Kesetimbangan
Asas Le Chatelier
Jika terhadap suatu kesetimbangan dilakukan suatu aksi (tindakan) maka reaksi akan bergeser untuk menghilangkan pengaruh aksi itu.
Pengaruh Konsentrasi
Pengaruh Volume
PENTING !! Angka koefisien reaksi dari zat padat murni ( s ) dan zat cair murni ( l ) TIDAK mempengaruhi kesetimbangan yang mempengaruhi kesetimbangan adalah senyawa dalam bentuk larutan ( aq ) dan gas ( g ). Perhatikan contoh untuk pengaruh volume dan konsentrasi :


Kc nya berturut-turut adalah 4 dan 8 maka tetapan kesetimbangan bagi reaksi :
adalah !
Untuk mengetahui perubahan nilai tetapan kesetimbangan ( K ) yang kita perhatikan adalah senyawa yang spesifik yang ada untuk tiap-tiap reaksi.
untuk reaksi pertama yang kita perhatikan perubahannya adalah senyawa B karena senyawa B tidak ada pada reaksi ke dua. Senyawa B yang mula-mula di ruas kiri menjadi di ruas kanan dan dikalikan 2 (karena angka koefisiennya berubah dari 1 menjadi 2 berarti berubah menjadi dua kalinya).
maka reaksinya ditulis :

karena dibalik maka K = 4 menjadi K = 1/4 kemudian dikalikan 2 maka K = 1/4 berubah lagi menjadi kuadratnya K = (1/4)2 = 1/16
untuk reaksi kedua tidak mengalami perubahan karena senyawa spesifiknya yaitu senyawa D tetap ada di ruas kiri dan angka koefisiennya pun tetap = 1 sehingga K nya juga tetap 8. Dari reaksi pertama yang telah diubah dengan reaksi kedua digabung menjadi :
senyawa yang sama di ruas kiri dan kanan saling coret....
karena digabung maka nilai K = 1/16 dan K = 8 dikalikan sehingga menjadi :
K = 1/16 . 8 = 1/2
Pergeseran Kesetimbangan
Asas Le Chatelier
Jika terhadap suatu kesetimbangan dilakukan suatu aksi (tindakan) maka reaksi akan bergeser untuk menghilangkan pengaruh aksi itu.
Pengaruh Konsentrasi
- Jika salah satu pereaksi/reaktan/senyawa di ruas kiri diperbesar maka kesetimbangan akan bergeser ke ruas kanan/produk/hasil reaksi. Sebaliknya jika salah satu produk/hasil reaksi/ruas kanan diperbesar maka kesetimbangan akan bergeser ke ruas kiri/pereaksi/reaktan.
- Jika salah satu pereaksi/reaktan/senyawa di ruas kiri diperkecil maka kesetimbangan akan bergeser ke ruas kiri/pereaksi/reaktan. Sebaliknya jika salah satu produk/hasil reaksi/ruas kanan diperkecil maka kesetimbangan akan bergeser ke ruas kanan/produk/hasil reaksi.
Pengaruh Volume
- Jika volume diperbesar (pengenceran) maka kesetimbangan akan bergeser ke arah reaksi yang jumlah molekulnya terbanyak atau ke ruas yang jumlah angka koefiseinnya terbanyak.
- Jika volume diperkecil (pemekatan) maka kesetimbangan akan bergeser ke arah reaksi yang jumlah molekulnya terkecil atau ke ruas yang jumlah angka koefiseinnya terkecil.
- Jika jumlah angka koefisien ruas kanan dan ruas kiri sama maka penambahan atau pengurangan volume tidak akan menggeser kesetimbangan.
PENTING !! Angka koefisien reaksi dari zat padat murni ( s ) dan zat cair murni ( l ) TIDAK mempengaruhi kesetimbangan yang mempengaruhi kesetimbangan adalah senyawa dalam bentuk larutan ( aq ) dan gas ( g ). Perhatikan contoh untuk pengaruh volume dan konsentrasi :
ke arah mana kesetimbangan bergeser jika suhu tetap :
a. ditambah BiCl3
b. ditambah air
c. ditambah BiOCl
d. ditambah HCl
e. ditambah NaOH
Jawab :
a. Penambahan BiCl3, salah satu pereaksi, akan menggeser kesetimbangan ke kanan
b. Penambahan air (memperbesar volume) akan menggeser kesetimbangan ke kanan karena koefisien ruas kanan lebih besar dari ruas kiri. Alasannya : koefisien ruas kiri = 1 yaitu koefisien BiCl3, ingat koefisien H2O tidak usah dihitung karena zat cair murni ( l ) sedangkan jumlah koefisien di ruas kanan = 2 yaitu koefisien dari HCl, ingat BiOCl tidak diperhitungkan karena bentuknya padat ( s ).
c. Penambahan BiOCl yang merupakan komponen padat tidak menggeser kesetimbangan.
d. Penambahan HCl, salah satu produk, akan menggeser kesetimbangan ke kiri.
e. Penambahan NaOH akan bereaksi dengan HCl yang berarti mengurangi salah satu produk, maka kesetimbangan akan bergeser ke kanan.
Pengaruh Tekanan
pengaruh tekanan berlawanan dengan pengaruh volume :
- Jika tekanan diperbesar maka kesetimbangan akan bergeser ke arah reaksi yang jumlah molekulnya terkecil atau ke ruas yang jumlah angka koefiseinnya terkecil.
- Jika tekanan diperkecil maka kesetimbangan akan bergeser ke arah reaksi yang jumlah molekulnya terterbesar atau ke ruas yang jumlah angka koefiseinnya terbesar.
- Jika jumlah angka koefisien ruas kanan dan ruas kiri sama maka penambahan atau pengurangan tekanan tidak akan menggeser kesetimbangan.
Pengaruh Suhu
- Jika suhu sistem kesetimbangan dinaikkan maka reaksi sistem menurunkan suhu dengan cara kesetimbangan bergeser ke pihak reaksi yang menyerap kalor (endoterm).
- Jika suhu sistem kesetimbangan diturunkan maka reaksi sistem menaikkan suhu dengan cara kesetimbangan bergeser ke pihak reaksi yang melepas kalor (eksoterm).
Ke arah mana kesetimbangan akan bergeser jika suhu dinaikkan !
Pada kenaikan suhu kesetimbangan akan bergeser ke arah reaksi endoterm ( delta H nya + ) :
a. Pada reaksi pertama kesetimbangan akan bergeser ke kiri karena reaksi pertama dari kiri ke kanan adalah reaksi eksoterm ( delta H nya - ) maka reaksi endotermnya kebalikannnya yaitu dari kanan ke kiri
b. Pada reaksi kedua kesetimbangan akan bergeser ke kanan karena reaksi kedua dari kiri ke kanan adalah reaksi endoterm ( delta H nya + ) maka reaksi endotermnya sudah sesuai yaitu dari kiri ke kanan
Pengaruh Katalisator
Dalam suatu reaksi kesetimbangan, pengaruh katalisator adalah mempercepat terjadinya reaksi sehingga reaksi maju dan reaksi baliknya sama-sama bertambah kuat. Oleh karena itu, katalisator tidak mempengaruhi susunan kesetimbangan akan tetapi mempercepat tercapainya keadaan setimbang.
Menentukan Tetapan Kesetimbangan ( Kc )
Memperdalam tentang tetapan kesetimbangan yang telah disinggung sebelumnya.
Tetapan kesetimbangan adalah hasil kali konsentrasi setimbang zat di ruas kanan
dibagi hasil kali konsentrasisetimbang zat di ruas kiri, masing-masing konsentrasi zat dipangkatkan dengan koefisien reaksinya.

Persamaan tetapan kesetimbangannya adalah :

Tetapan kesetimbangan untuk reaksi yang sama "harganya tetap untuk suhu yang tetap"
zat padat murni ( s ) dan zat cair murni ( l ) TIDAK disertakan dalam penyusunan tetapan kesetimbangan

BiOCl (s) dan H2O tidak disertakan dalam persamaan Kc karena bertutut-turut bentuknya zat padat (s) dan zat cair murni ( l ).
Contoh Soal 1 :
Metana (CH4) dapat diperoleh dari dari reaksi gas CO2 dan gas H2 menurut persamaan :
Reaksi ini berlangsung pada suhu tinggi dengan suatu katalisator. Ke dalam ruangan 500 ml mula-mula dimasukkan 1 mol gas CO dan 3 mol gas H2 diperoleh 0,387 mol air. Tentukan besarnya tetapan kesetimbangannya pada suhu tersebut !
Jawab :
Mula-mula kalian buat bagan seperti di bawah ini :
lalu kalian isikan nilai mol senyawa di bawah senyawanya sesuai dengan keterangan soal ( angka yang berwarna hitam ). ingat mol H2O sebesar 0,378 mol diisikan di bagian setimbang. karena mula-mula H2O tidak ada kemudian diperoleh / saat setimbang 0,378 mol. Karena mula-mula tidak ada kemudian saat setimbang menjadi 0,378 juga berarti saat bereaksi menghasilkan H2O sebesar 0,378 mol juga. Saat reaksi perbandingan mol = perbandingan angka koefisien, isikanlah mol saat reaksi untuk semua senyawa berdasarkan mol H2O saat reaksi sebesar 0,378 mol dikalikan angka koefisiennya masing-masing ( angka yang berwarna merah ). Mol saat setimbang di ruas kiri = mol mula-mula - mol setimbang dan di ruas kanan mol saat setimbang = mol mula-mula + mol setimbang. Hasilnya diisikan di bagian setimbangnya ( angka berwarna biru ).
angka yang dipakai untuk menyusun Kc adalah angka saat keadaan setimbang... tetapi ingat, bukan dalam mol namun dalam konsentrasi ( M )

karena volemenya 500 ml = 0,5 liter maka setiap molnya dibagi 0,5 :
CO = 0,622 mol / 0,5 l = 1,244 M
H2 = 1,866 mol/ 0,5 l = 3,732 M
CH4 = H2O = 0,378 mol / 0,5 l = 0,756 M
Harga Kc yang kecil menunjukkan reaksi ini hanya membentuk sedikit sekali metana (CH4)
Contoh Soal 2 :
Harga Kc untuk reaksi di bawah ini dalam suhu tertentu adalah 49

Pada suatu percobaan, 2 mol H , 2 mol I dan 4 mol HI dicampur dalam suatu ruangan 1 liter pada suhu yang sama. Tentukan mol HI saat mencapai keadaan setimbang !
Jawab :
Misalkan H yang bereaksi x mol maka :
Pada saat setimbang :

karena volumenya 1 liter maka mol = konsentrasinya ( ingat : M = mol/volume )

kedua ruas diakar :
14 - 7x = 4 + 2x
10 = 9x
x = 10/9 = 1,11
maka saat setimbang mol HI = (4 + 2x) = 6,22 mol
Contoh Soal 3 :
Dalam bejana 1 dm3 terdapat kesetimbangan antara 0,05 mol N2; 0,20 mol H2; dan 0,10 NH3. Untuk meningkatkan jumlah NH3 menjadi 0,20 mol dalam suhu dan volume tetap harus ditambahkan N2 sebanyak....
Jawab :

karena dalam suhu yang sama Kc tidak berubah maka berlaku Kc1 = Kc2
Ingat.... mol tiap-tiap senyawa tidak dibagi volume karena volumenya = 1 liter jika tidak satu liter maka mol tiap-tiap senyawa harus dibagi dengan volumenya seperti contoh soal no 1.
N2 = 4.0,05 = 0,20 mol
maka N yang ditambahkan = mol N setelah - mol N mula-mula = 0,20 mol - 0,05 mol = 0,15 mol
Kesetimbangan Dissosiasi
Disosiasi adalah peruraian suatu zat menjadi zat lain yang lebih sederhana
Derajad disosiasi adalah perbandingan antara jumlah zat yang terdisosiasi / terurai / bereaksi dengan jumlah zat mula-mula.

Contoh :
Jika 3 mol AB dalam satu liter air terurai sebanyak 40 % menurut reaksi :

maka tetapan kesetimbangan reaksi tersebut....
Jawab :
Derajad disosiasi = 40 % = 0,4
Tetapan Kesetimbangan Tekanan Parsial ( Kp )
tetapan kesetimbangan untuk sistem kesetimbangan gas juga dapat dinyatakan dengan tekanan parsial gas


, P = tekanan parsial senyawa gas
Perbandingan tekanan parsial = Perbandingan mol saat setimbang
Jika diketahui tekanan total suatu reaksi gas maka tekanan parsial tiap-tiap zatnya dapat ditentukan :
Jumlah mol total saat reaksi gas mencapai kesetimbangan dapat dicari dengan rumus gas ideal :
Hubungan Kc dan Kp :


Keterangan :
P = tekanan (atm)
V = volume (m)
n = mol
R = 0,082 L.atm/mol.K
T = Suhu ( K )
delta n = Jumlah koefisien gas kanan - Jumlah koefisien gas kiri
Contoh Soal :
Sebanyak 10 mol gas N2 dicampurkan dengan 40 mol gas H2 dalam suatu ruangan 10 liter kemudian dipanaskan pada suhu 427 C sehingga bereaksi membentuk NH3 menurut reaksi kesetimbangan :
Apabila tekanan total campuran pada keadaan setimbang adalah 230 atm. tentukanlah harga Kp !
Jawab :
dengan menggunakan persamaan gas ideal jumlah mol gas dalam campuran saat setimbang dapat dihitung sebagai berikut :

Hati2... suhu harus dalam Kelvin ( K ) maka T = 427 C + 273 = 700 K
misal jumlah mol N2 yang bereaksi = x mol maka susunan kesetimbangan dapat dihitung sebagai berikut :
karena jumlah mol totalnya = 40 mol maka x dapat dicari :
(10 - x) + (40 - 3x) + 2x = 40
-2x = -10
x = 5
susunan mol saat kesetimbangan sebagai berikut :
N2 = 10 - x = 5 mol
H2 = 40 - 3x = 25 mol
NH3 = 2x = 10 mol
Tekanan Parsial gas saat setimbang :
tekanan parsial N2 = 5/40 . 230 atm = 28,75 atm
tekanan parsial H2 = 25/40 . 230 atm = 143,75 atm
tekanan parsial NH3 = 10/40 . 230 atm = 57,50 atm